无机及分析化学知识点及公式汇总是什么?
无机及分析化学知识点及公式汇总如下。
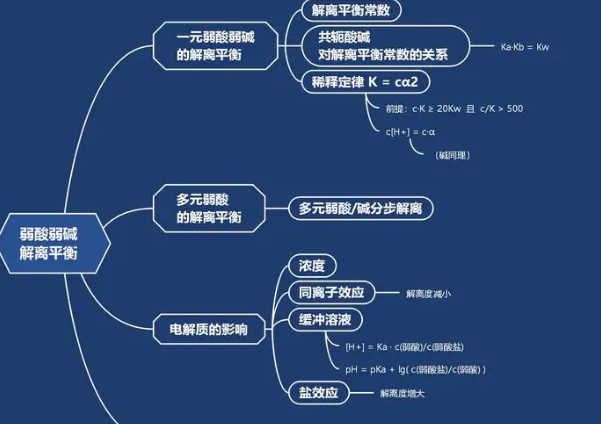
系统误差:由固定因素引起的误差,具有单向性、重现性、可校正。
偶然误差:随机的偶然因素引起的误差,大小正负难以确定,不可校正,无法避免服从统计规律。绝对值相同的正负误差出现的概率相等。大误差出现的概率小,小误差出现的概率大。
准确度:在一定测量精度的条件下分析结果与真值的接近程度。
用误差衡量精密度(precision):多次重复测定某一量时所得测量值的离散程度。
用偏差衡量准确度与精密度的关系:精密度好是准确度好的前提,精密度好不一定准确度高。
测定结果的数据处理:对于偏差较大的可疑数据按Q检验法进行检验,决定其取舍;计算出数据的平均值、平均偏差与标准偏差等。
有效数字:实际能测得的数据,其最后一位是可疑的。对于可疑数字一般认为有+1的误差。例:滴定管读数21.09mL,分析天平读数02080g,最后一位为可疑值。
对数值:pH、pOH、pM、pK等,有效数字的位数取决于小数部分的位数。
加减法:计算结果小数点后的位数与小数点后位数最少的数据一样。
乘除法:乘方、开方、对数的计算结果的有效位数与有效位数最少的数据一样。
ΔrHθm 的计算
ΔrHθm:摩尔反应焓变,对于给定的化学反应反应进度为lmol时的反应热。
ΔrHθm:化学反应中,任何物质均处于标准状态下,该反应的摩尔反应焓变。
ΔβHθm:在温度T及标准态下,由参考状态单质生成1mol物质B的标准摩尔反应焓变即为物质B在T温度下的标准摩尔生成焓。参考状态单质的标准生成焓为零。
利用 ΔβHθm计算:ΔrHθmΔrHθm(298.15K)=∑vвΔ ΔrHθB(298.15K), ΔrHθm≈ΔβHθm(298.15K)。
盖斯定律:在恒容或恒压同时只做体积功的情况下,任一化学反应,不论是一步完成的,还是分几步完成的,其化学反应的热效应总是同的,即化学反应热效应只与始、终状念有关而与具体途径无关。根据益斯定律若化学反应可以加和,则共反应热也可以加和。
化学反应速率的表示方法(浓度随时间的变化)瞬时速率、平均速率化学反应速率理论(碰撞理论、过渡状态理论)。
活化分子、活化能(能用化学反应速率理论解释浓度、温度、催化剂对反应速率的影响)。
质量作用定律:(只适用于基元反应)速率方程、反应级数。
影响反应速率的因素:
1、内因:反应的活化能人小。
2、外因:浓度、温度、催化剂(不要求计算)。
标签:知识点,分析化学,汇总